Primeiro implante cerebral Neuralink tem falha de funcionamento detectada
Empresa de Elon Musk divulgou o erro e irá enfrentar problemas para a aprovação de mais um implante

A companhia de tecnologia cerebral de Elon Musk, Neuralink, revelou nesta quarta-feira (08), que o dispositivo implantado no primeiro paciente humano apontou alguns problemas técnicos. Noland Arbaugh, de 29 anos, ficou paralisado dos ombros para baixo após um acidente de mergulho, e foi o primeiro voluntário do dispositivo.
Ele recebeu o implante em janeiro desse ano e, desde então, vem sendo monitorado para que a companhia avaliasse os avanços ou possíveis erros do dispositivo.
O que aconteceu
Segundo a Neuralink em seu blog corporativo, alguns dos fios de eletrodos que estavam no tecido cerebral de Arbaugh se retraíram, ocasionando um mau funcionamento do aparelho. A empresa apontou que realizou correções de softwares que melhoraram o dispositivo e retomaram o desenvolvimento do paciente.
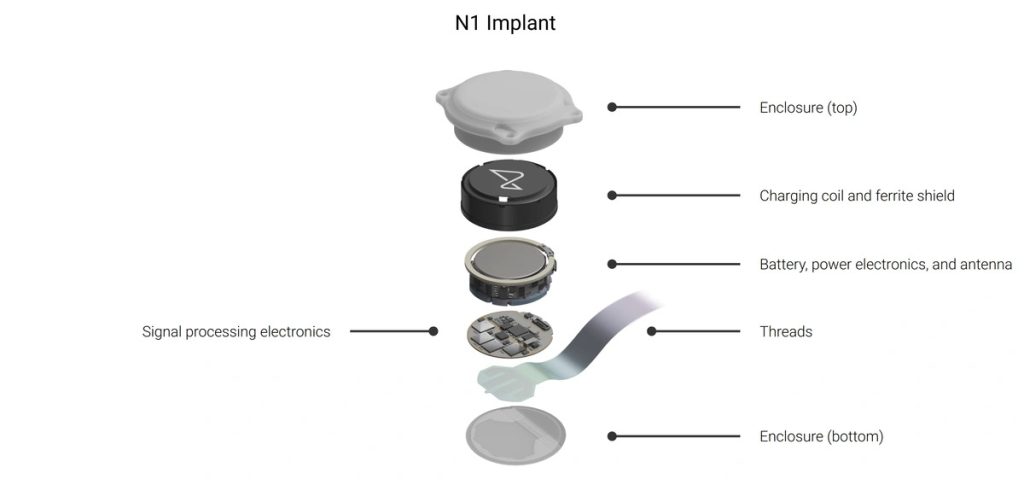
A corporação ainda garantiu no comunicado que pretende expandir o aparelho para cadeiras de rodas e braços mecânicos, além de estar focando no aprimoramento do controle do cursor e da entrada de texto do dispositivo.
Opinião de especialistas
Alguns especialistas em implantes cerebrais conversaram com a agência de notícias Bloomberg e revelaram que esses problemas devem ter sido apresentados após os fios se conectarem a um instrumento dentro do osso do crânio, e não na superfície do tecido cerebral.
O cérebro humano se move dentro do seu espaço intracraniano e, para os cientistas, qualquer balançar de cabeça ou movimento brusco pode provocar mudanças no aparelho. Eles ainda afirmam que os testes realizados em animais já podiam indicar estas possíveis adversidades, pois os cérebros deles são pequenos e não se deslocam como o do ser humano.
Ver essa foto no Instagram
Testes feito com o paciente Noland Arbaugh (foto: reprodução/Instagram/@neura.link)
O defeito já tinha sido revelado pelo jornal The Wall Street, mas sem nenhuma confirmação pela empresa de Elon Musk. A Neuralink, neste momento, tentava conseguir implantar o aparelho em mais pessoas, mas o obstáculo pode fazer com que a agência americana de alimentos e medicamentos, Food and Drug Administration (FDA), prorrogue a aprovação até o procedimento ser considerado seguro.